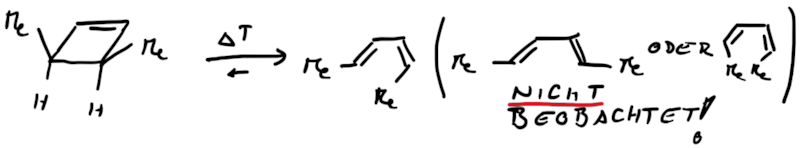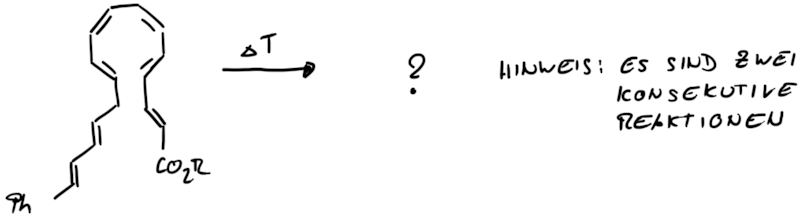Electrocyclisierungen
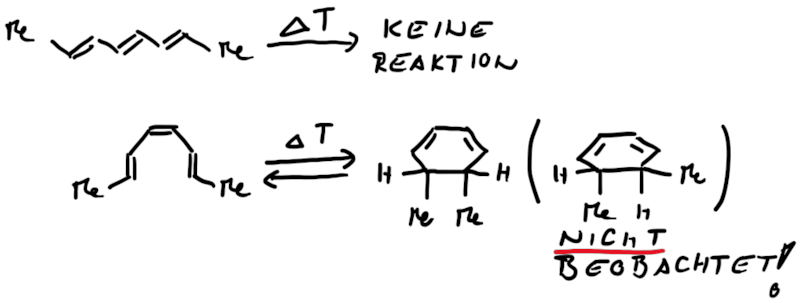
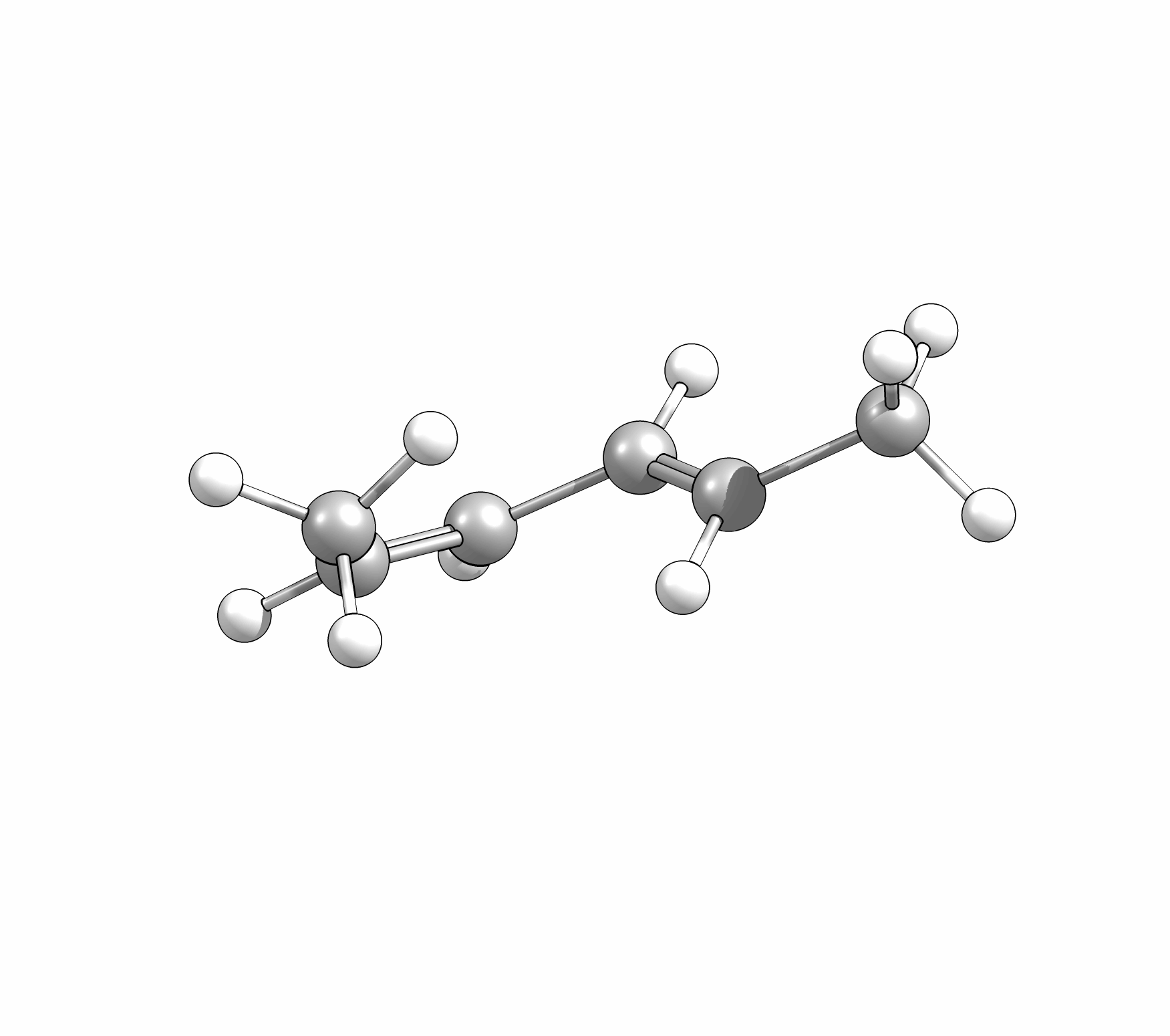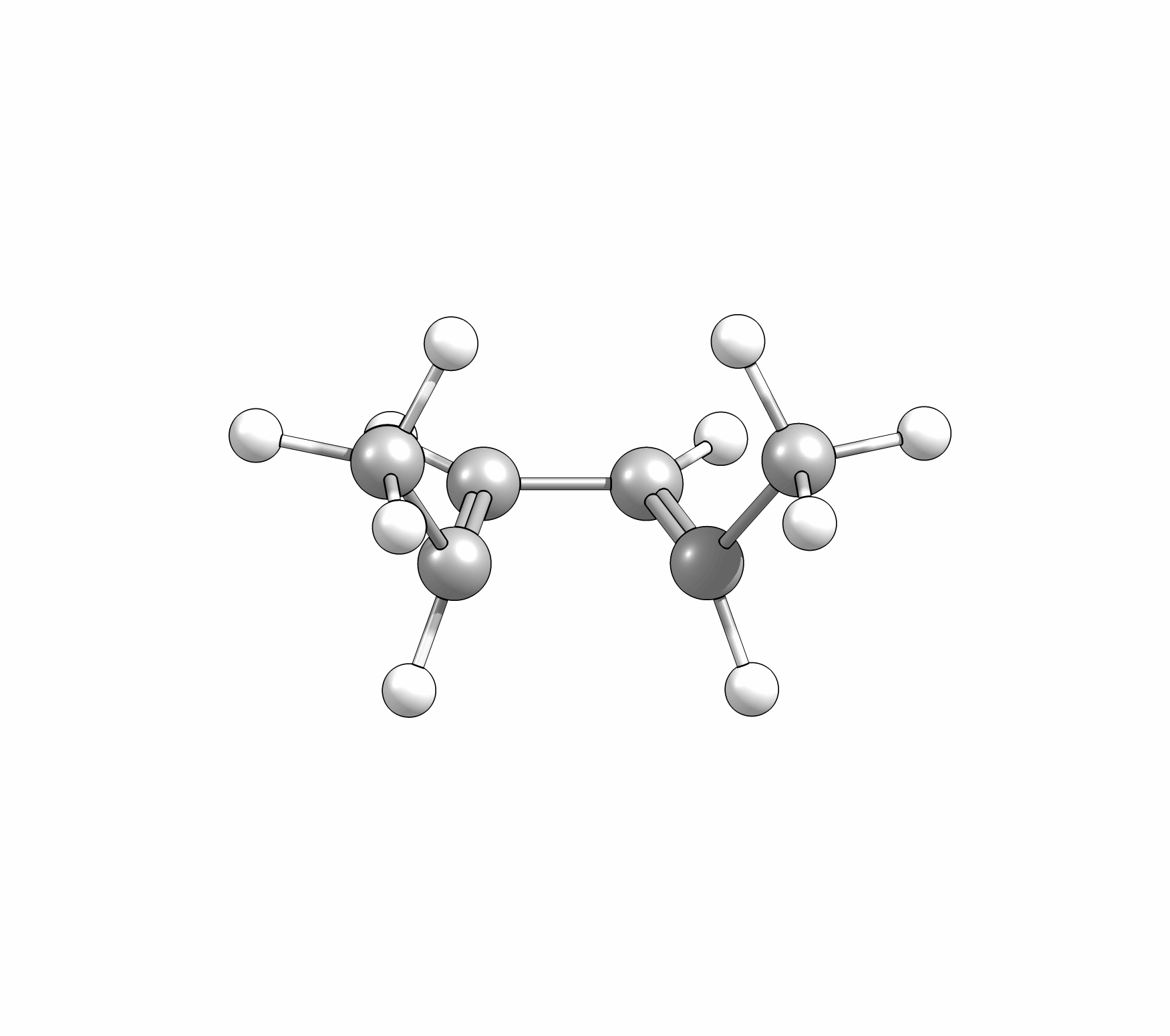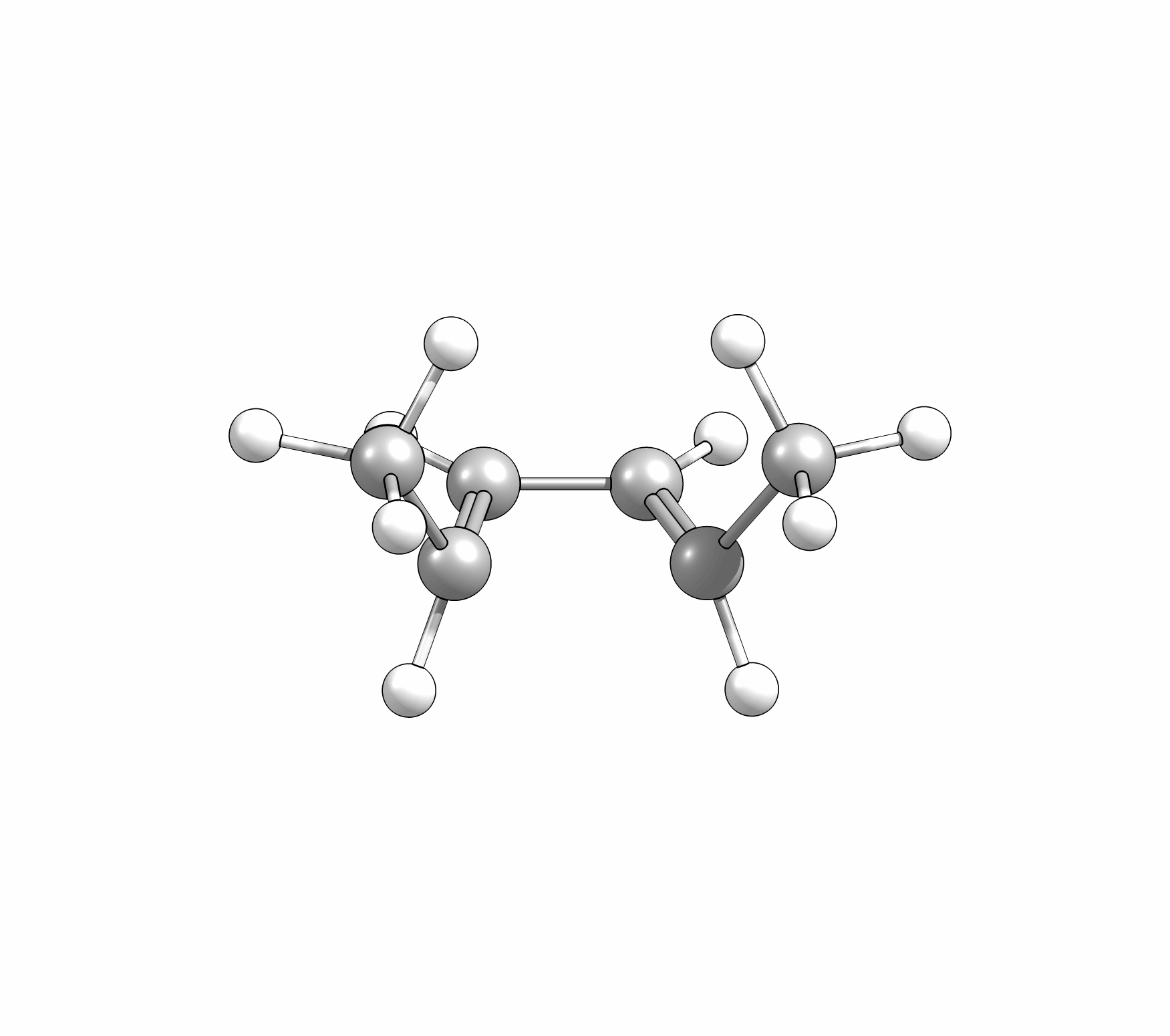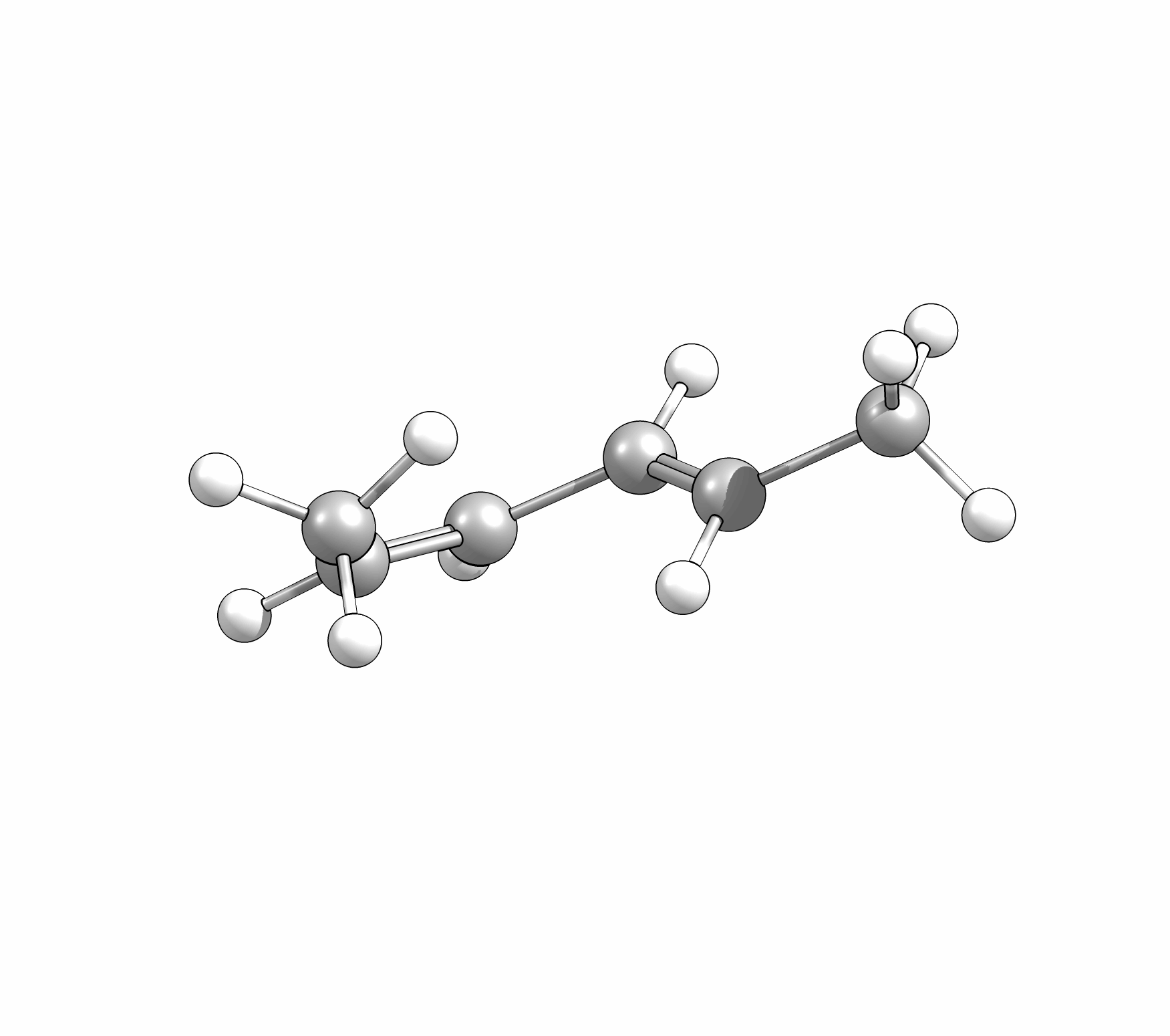
Ähnlich wie Cycloadditionen sind auch Elektrocyclisierungen pericyclische Reaktionen. Ein Hinweis auf die Notwendingkeit der Orbitalüberlappung, uns somit auch geometrische Grundvoraussetzung, schein die räumliche Nähe zweier π-Systeme zu sein. So reagiert das (1E,3Z,5E)-1,6-Diphenylhexa-1,3,5-trien unter Ausbildung des 1,2-Diphenyl-cyclohexa-3,5-diens, während das all-E-Derivat keiner Cyclisierung unterliegt (Abb.3.1)
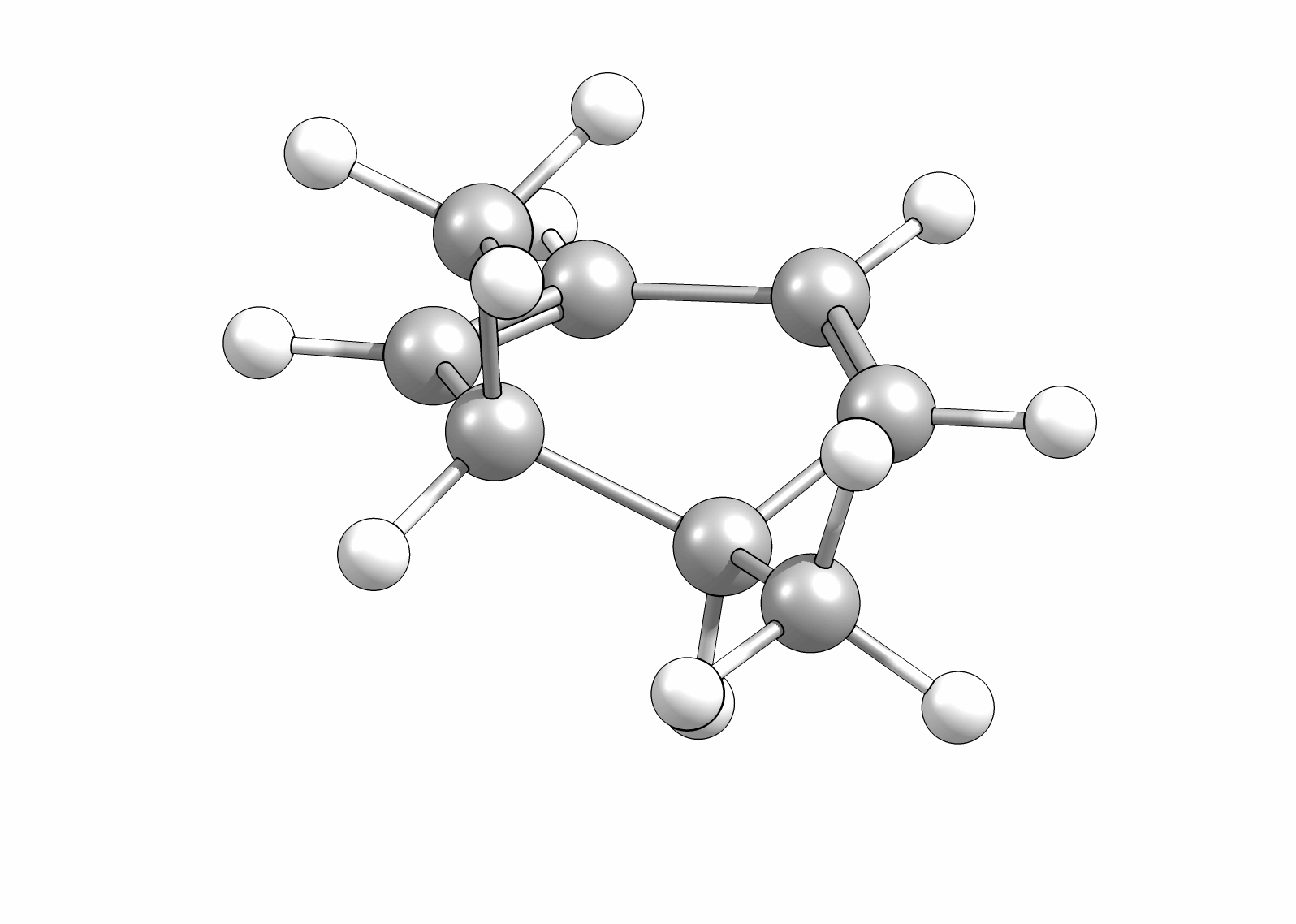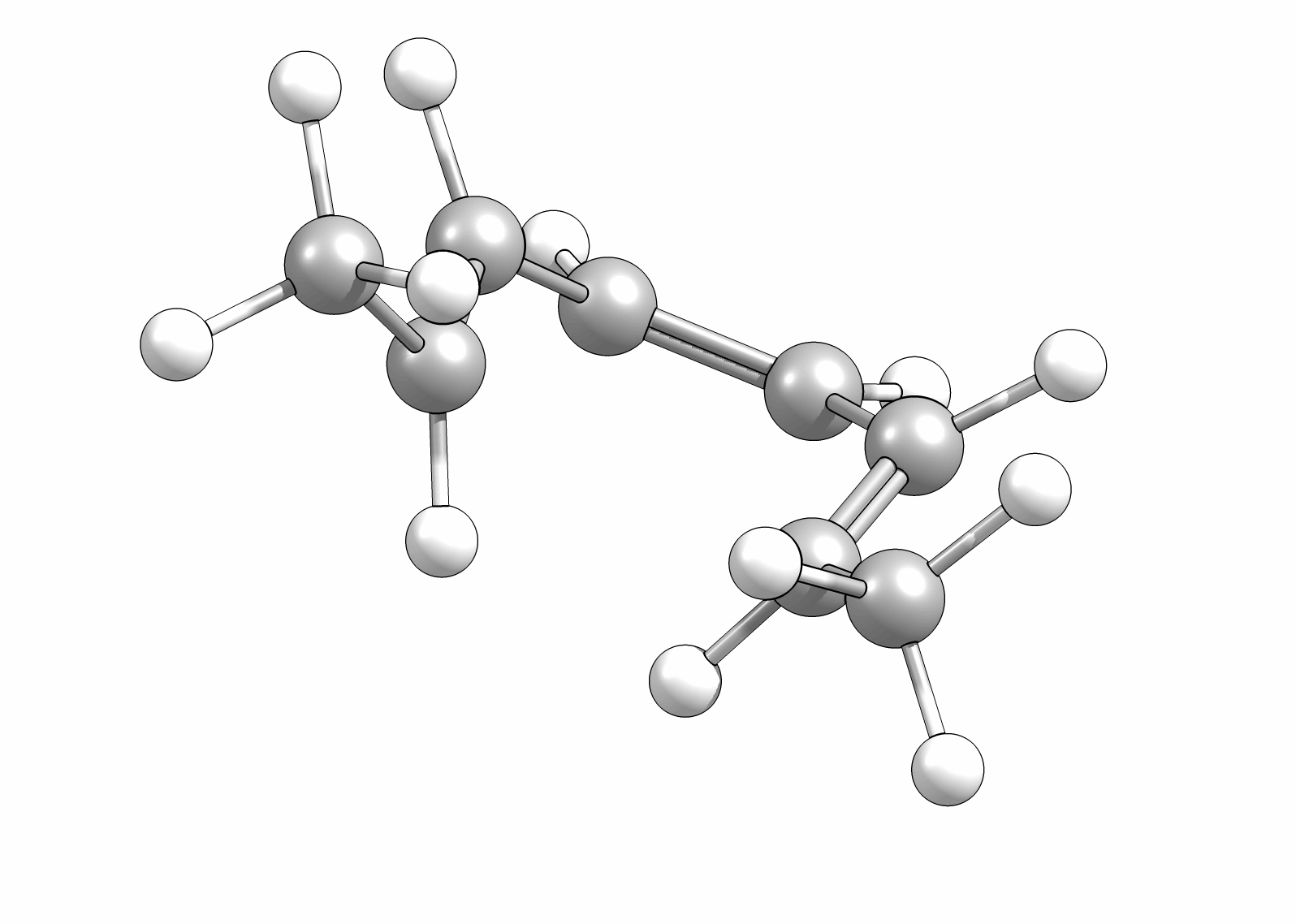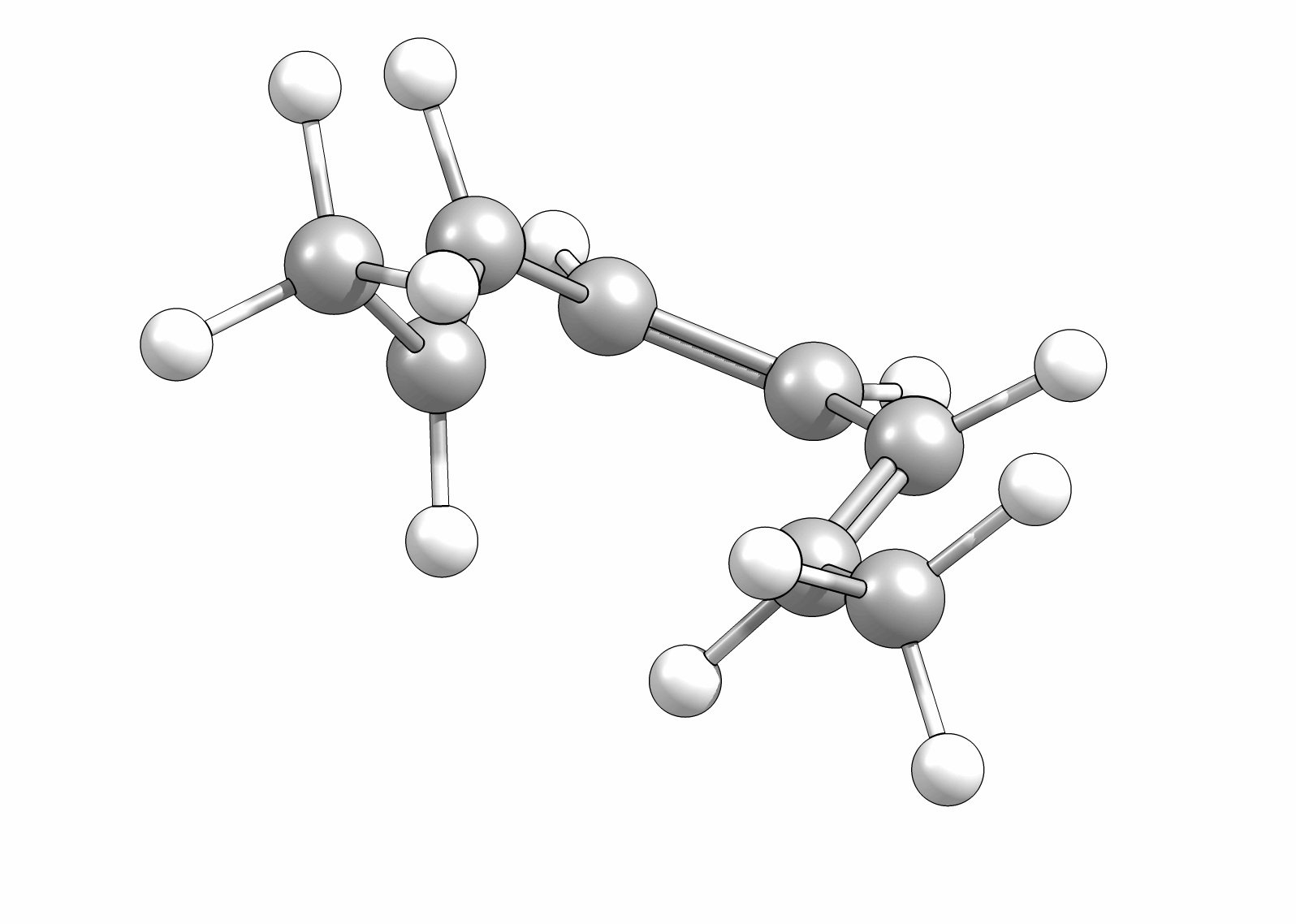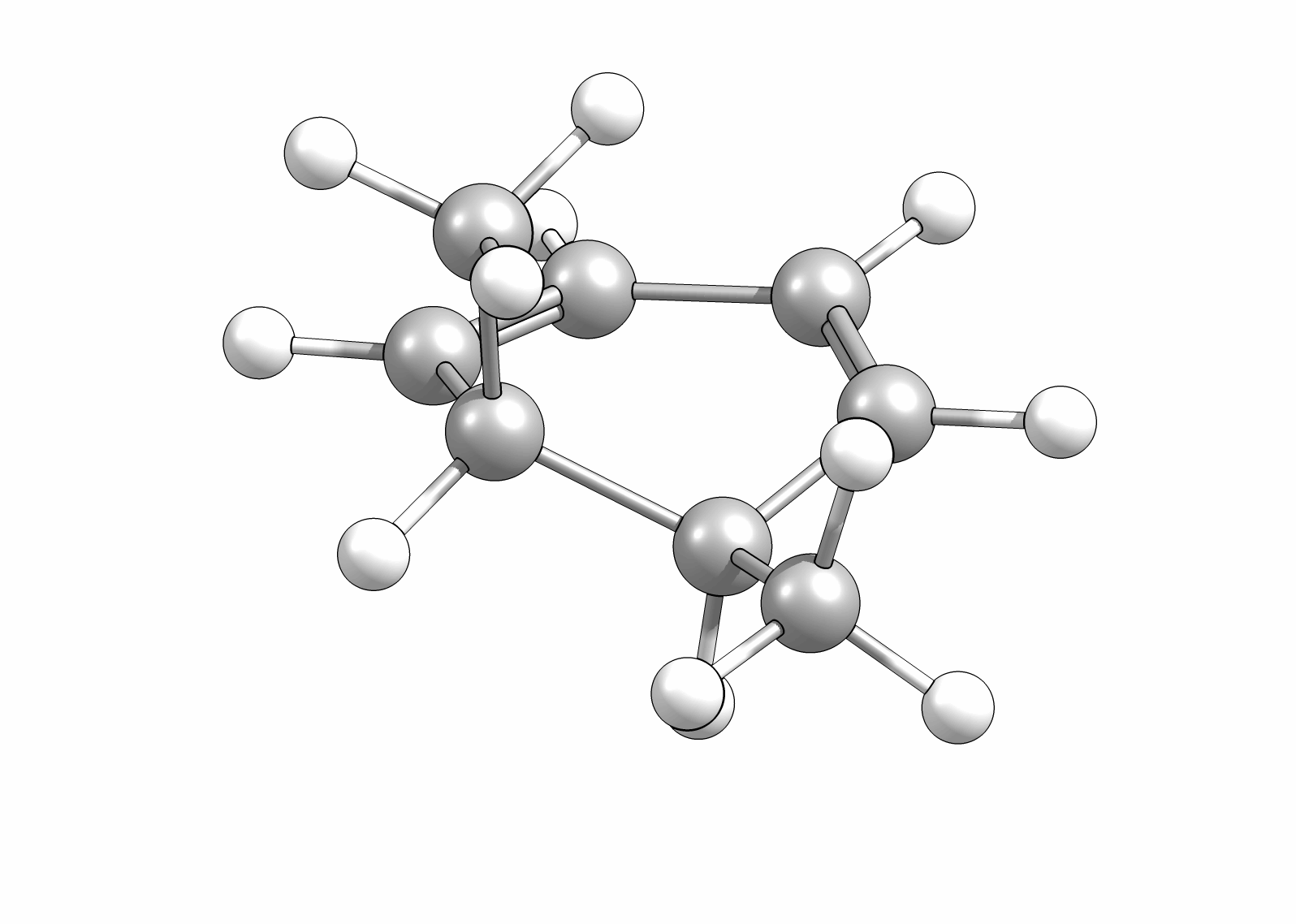
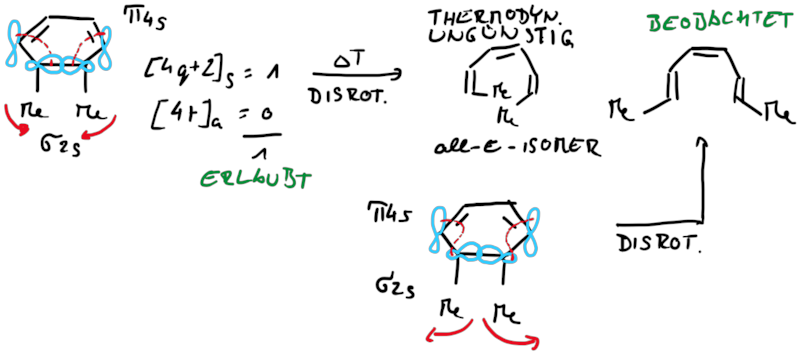
Das Cyclisierungsprodukt wird ausschliesslich als cis-Diastereomer gebildet. Das Gleichgewicht für diese Elektrocyclisierung liegt auf der Cyclohexadien-Seite. Wird das Produkt isoliert und wieder thermischen Bedingungen ausgesetzt, öffent sich der Ring wieder zum E,Z,E-Hextatrien und die Gelichgewichtskonzentration wird eingestellt. Diese Ringöffung wird auch beim cis-1,2-Dimethylcyclobuten beobachtet. Aufgrund der Ringspannung des Cyclobutens liegt das Gleichgewicht auf der Butadienseite (Abb.3.2).
Bei der Reaktion wird aber ausschliesslich das E,Z-Diastereomer, und nicht wie erwartet das thermodynamisch stabilere E,E- oder das am wenigsten stabile Z,Z-Diastereomer, gebildet.
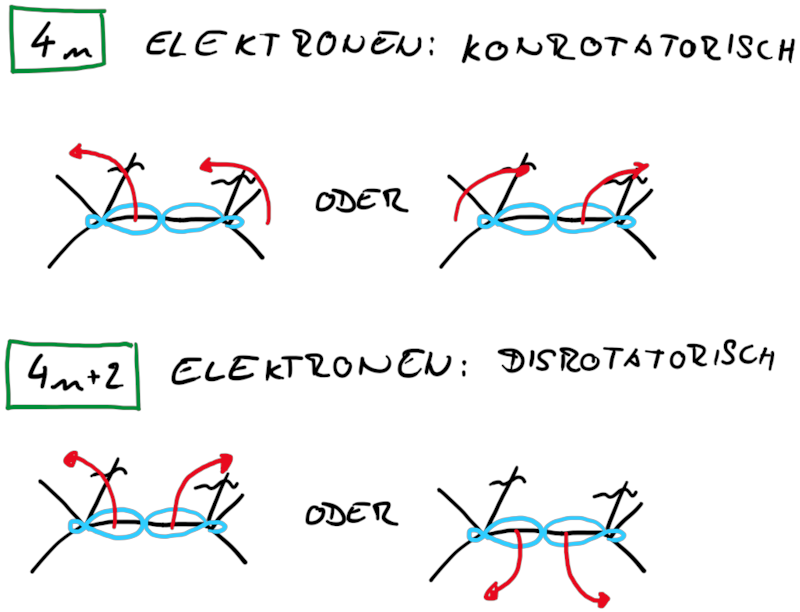
Wie Animationen für beide Ringöffnungen zeigen, erfolgt bei Cyclohexadien die Öffungung unter Drehung der beiden Methylgruppen entgegengesetzter Richtung (disrotatorisch, also gegenläufig). Obwohl das Cyclobutenderivat ebenfalls cis-substituiert ist, drehen sich die beiden Substituenten in die gleiche Richtung (conrotatorisch, geleichläufig). Im letzteren Fall kann die Rotation auch gegen den Uhrzeigersinn passieren, es liefert nur das identische Produkt. Grundsätzlich kann aber eine Selektivtät (Torquoselektivität) gefunden werden, wenn zwei unterschiedliche Substituenten am Ring verankert sind.
Warum ist dies der Fall?
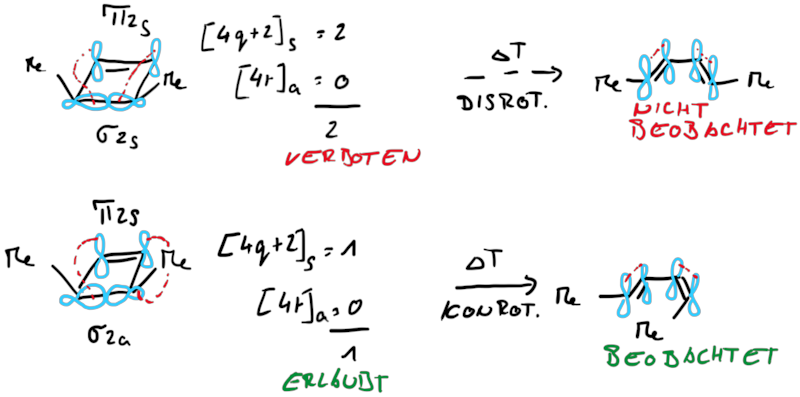
Betrachtet man die beiden Ringsysteme under deren Produkte stellt man fest, dass die Reaktionen sich in ihrer zu verschiebenden Elektronenanzahl unterscheiden, beim Cylohexadien sechs (vier Elektronen aus einer π-Bindung und zwei Elektronen aus einer σ-Bindung) und beim Cyclobuten vier (zwei Elektronen aus einer π-Bindung und zwei Elektronen aus einer σ-Bindung). Damit liegt die Vermutung nahe, dass die gesamt zu verschiebende Elektroenzahl einfluss auf die Stereoselektivität der Elektrocyclisierung hat und streng mit der Orbitalsymmetrie verknüft ist.
Diese Korrelation von Stereochemie, Elektronenanzahl und Orbitalsymmetrie lässt sich durch die Woodward-Hoffmann Regeln im Gegensatz zur Molekülorbitaltheorie leicht beschreiben (Hier sei nochmals angemerkt, dass die Woodward-Hoffmann Regeln auf der Molekülorbitaltheorie beruhen und der Vorteil in einer leichteren Analyse liegt).
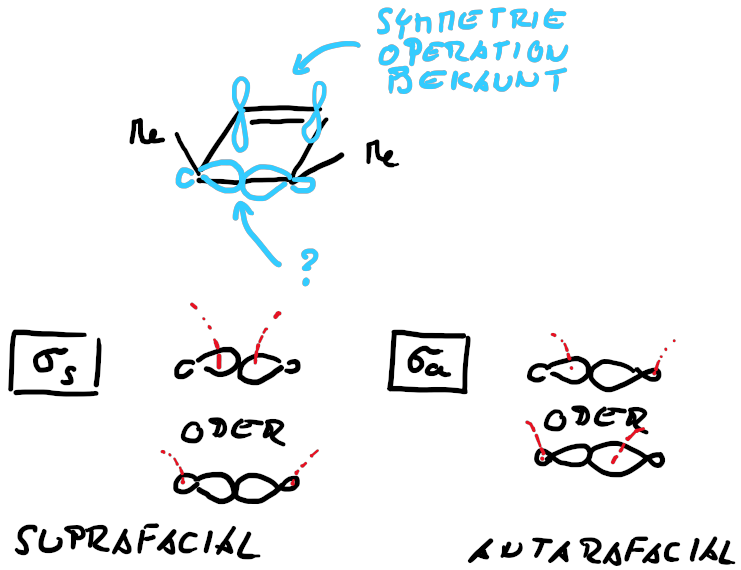
Allerding benötigen wir für die Anwendung der Woodward-Hoffmann Regeln für die Elektrocyclisierung noch die Beschreibung der σ-Bindung (Abb. 3.5).
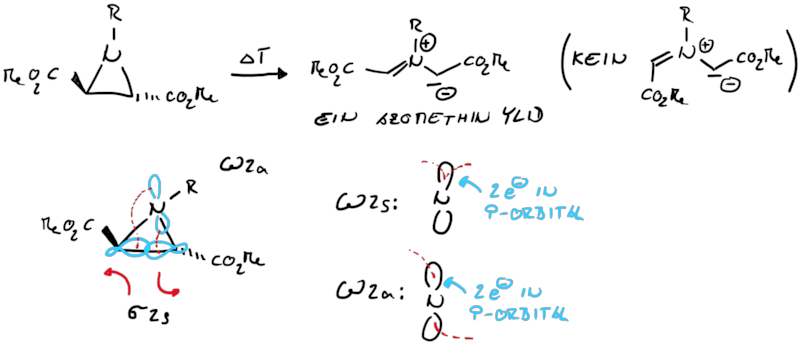
Dabei wird die Symmetrie eines Angrifft an der σ-Bindung durch die Wechselewirkungen mit den Orbitallappen symnbolisiert. Dadurch ergeben sich wieder syprafaciale und antarafaciale Angriffe, die wir für die Analyse heranziehen können. Bei der Ringöffung wird aus jedem σ-Orbital ein weiteres π-Orbital, bzw. beim Ringschluss wird aus dem π-Orbital ein σ-Orbital. In beiden Fällen muss dies durch eine Drehung realisiert werden, woduch dich die dis- bzw. conrotatorische Reaktion ableiten lässt.
Beispiel: cis-Dimethylcyclobuten
Beispiel: cis-1,2-Dimethyl-3,5-cyclohexadien
Zusammenfassend findet man für Elektrocylisierungen mit Beteiligung von 4n und 4n+2 Elektronen entweder eine corotatorische und eine disrotatorische Reaktion:
Die gleiche Systematic kann für die Aziridin-Ringöffnung/Ringschluss angewandt werden, allerdings benötigen wir eine weitere Beschreibung für die Interaktion eines p-Orbitals mit einem σ- oder π-Orbital.
Fragen & Antworten
Was ist das Reaktionsprodukt der thermischen Behandlung des Polyens?