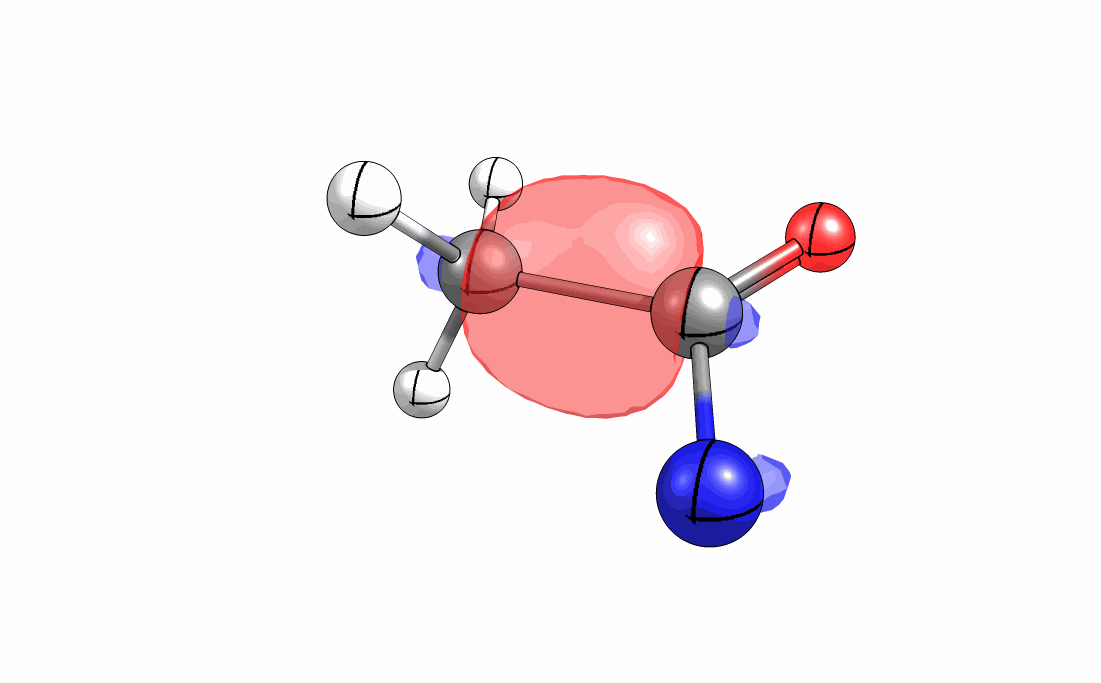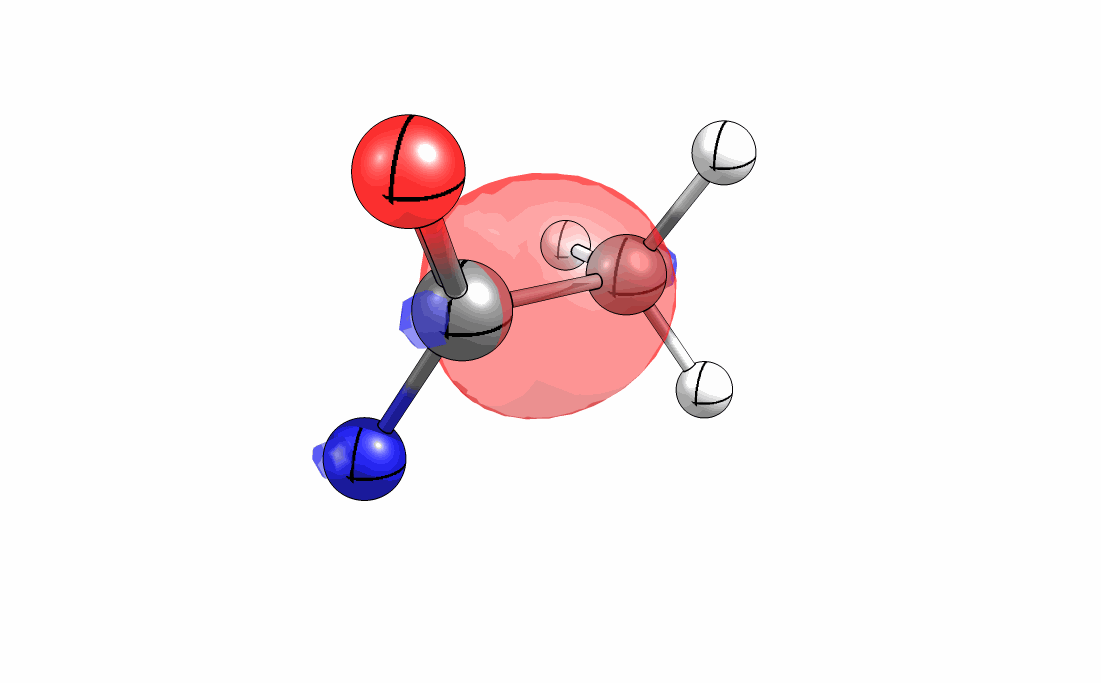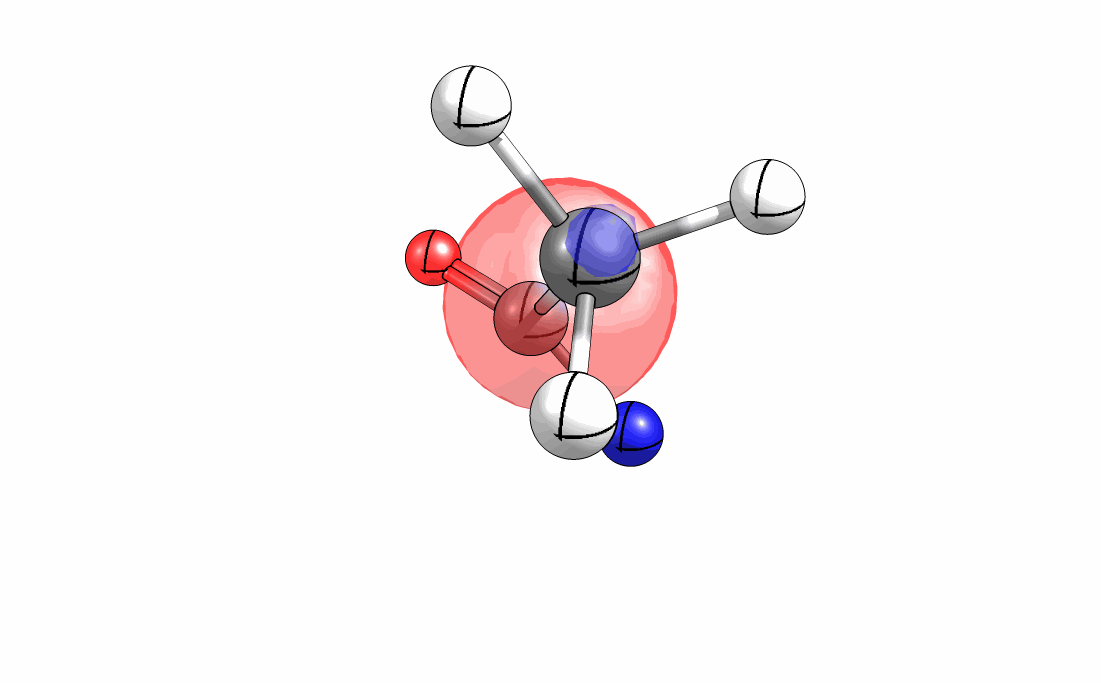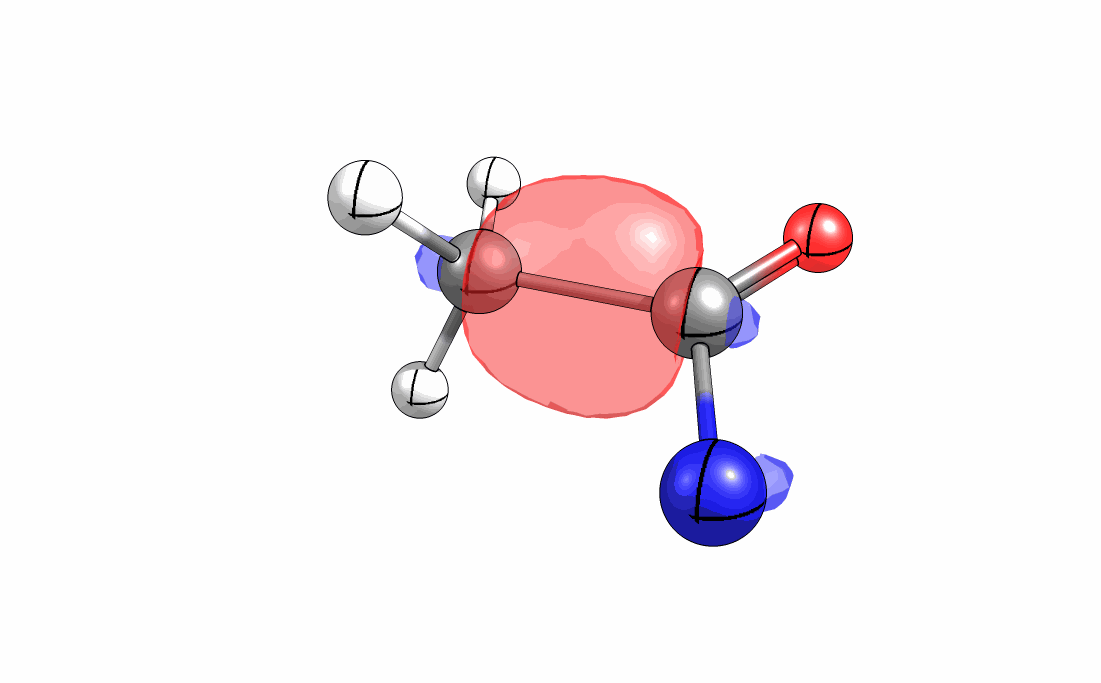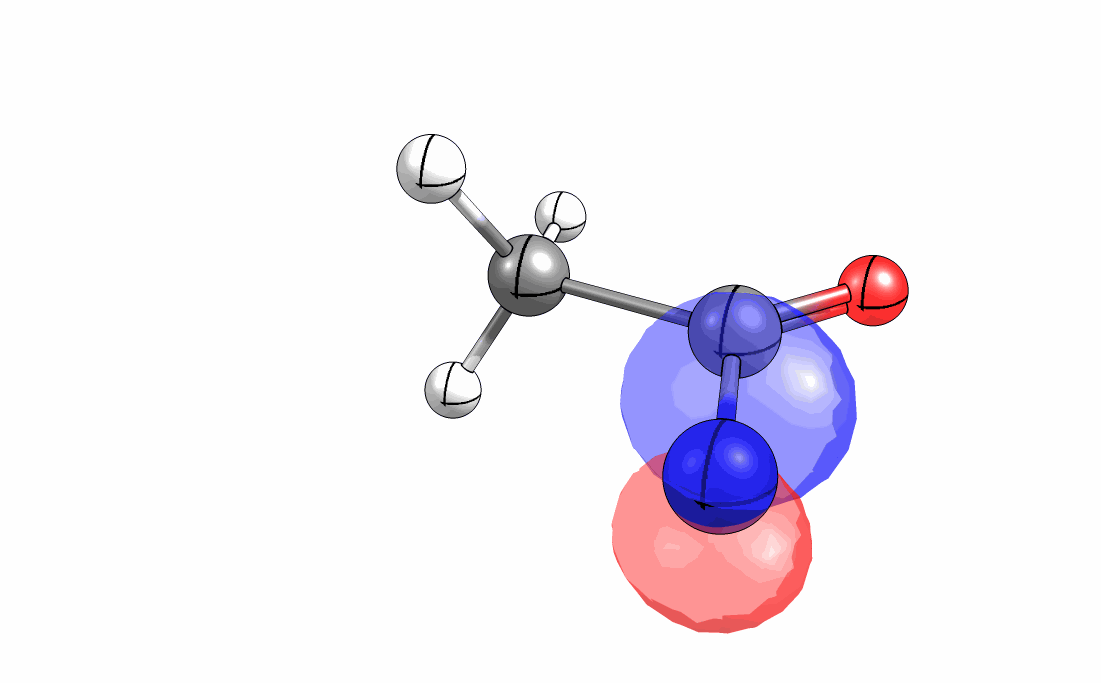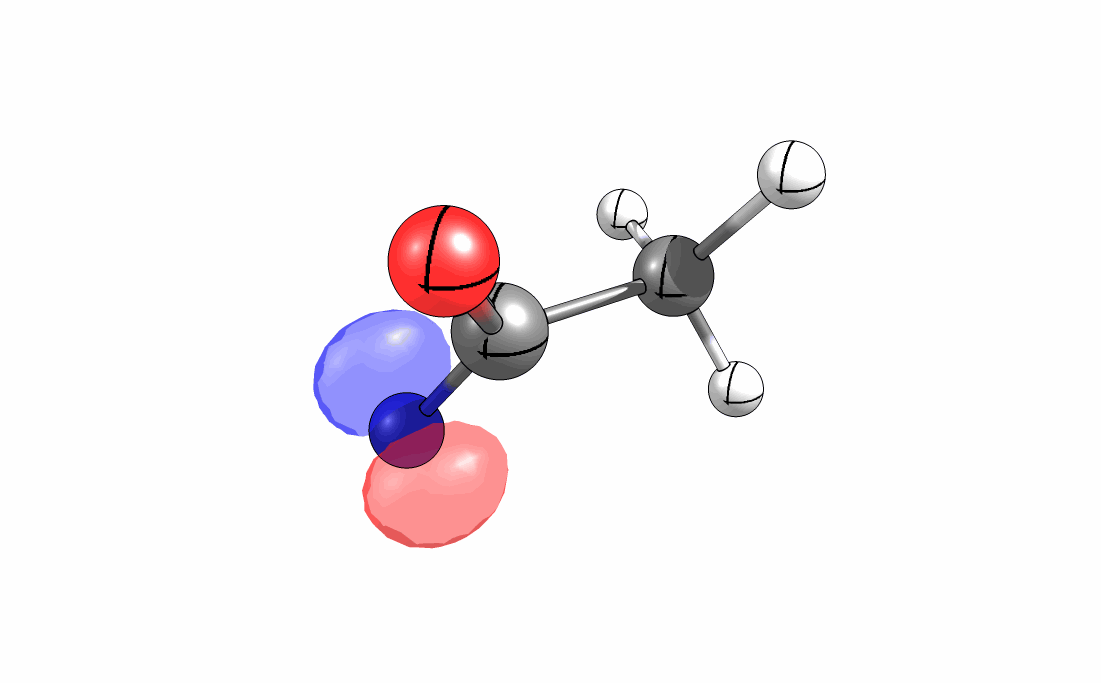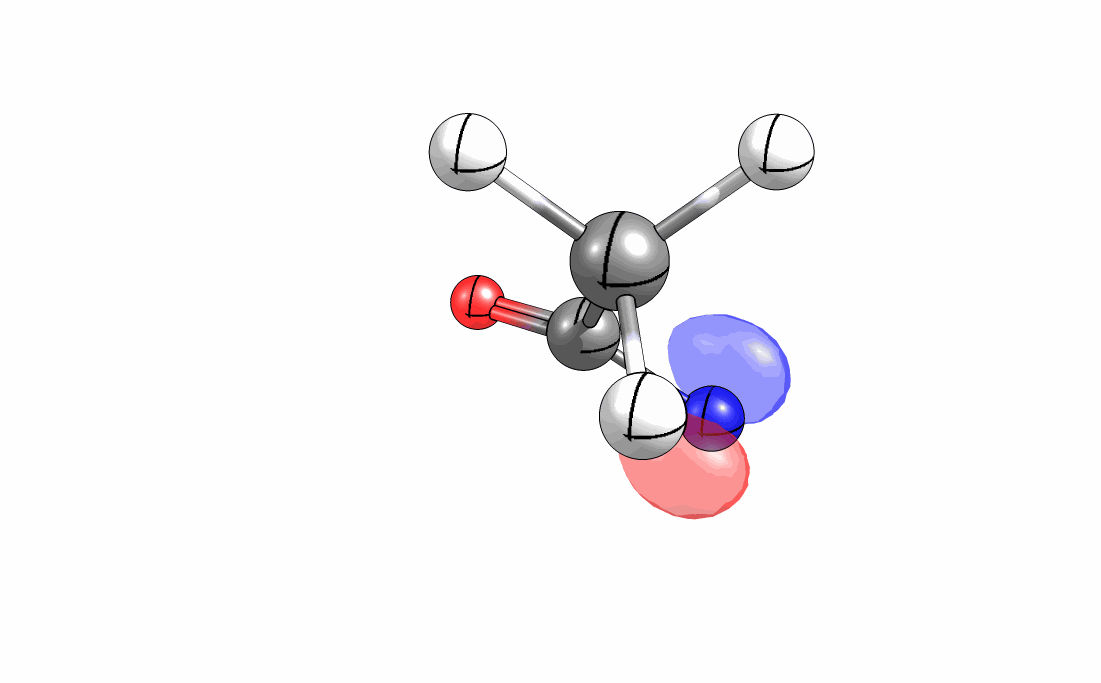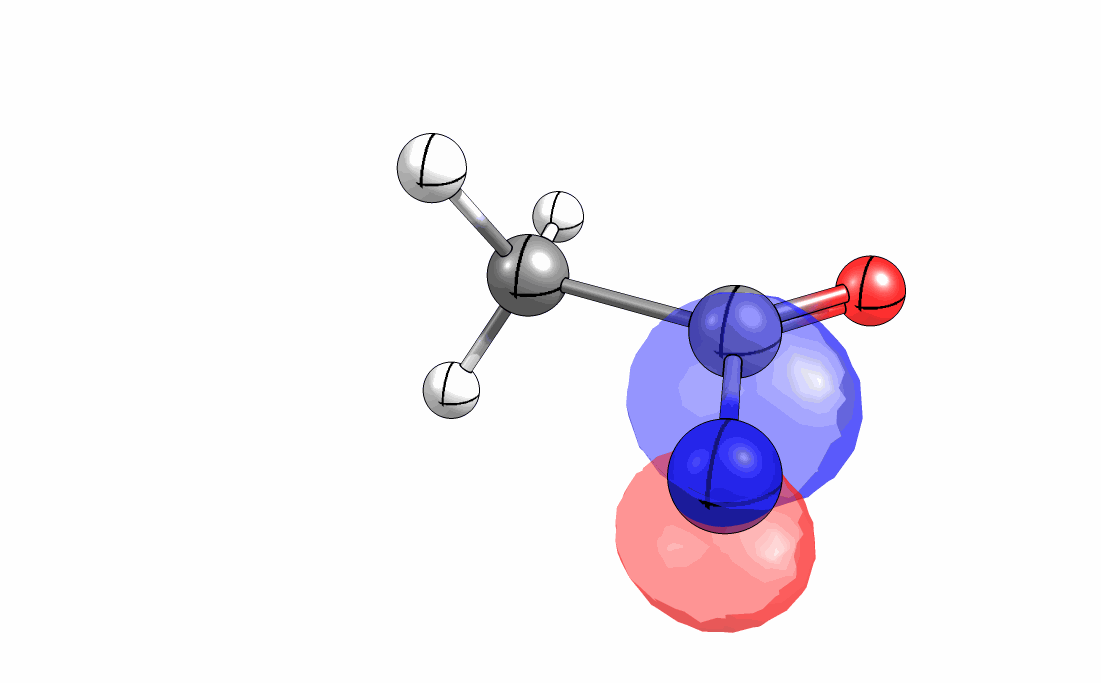Umlagerungen am elektronenarmen Stickstoffatom
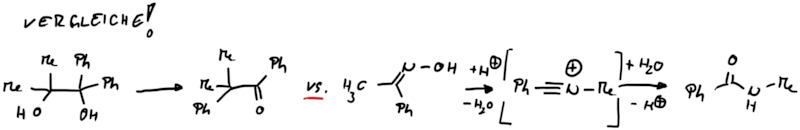
Im vorherigen Kapitel wurden Carben-induzierte Umlagerungen verdeutlicht. Ähnlich wie bei Carb-enen findet man bei den isoelektronischen Nitr-enen vergleichsweise Reaktivität (Abb.15.1).
Um die Orbitale zu betrachen, öfffnen Sie die Bilder in einem neuen Fenster.
Entsprechend sind auch ähnliche Umlagerungstypen an elektronenarmen Stickstoffverbindungen zu finden.
► Curtius Umlagerung
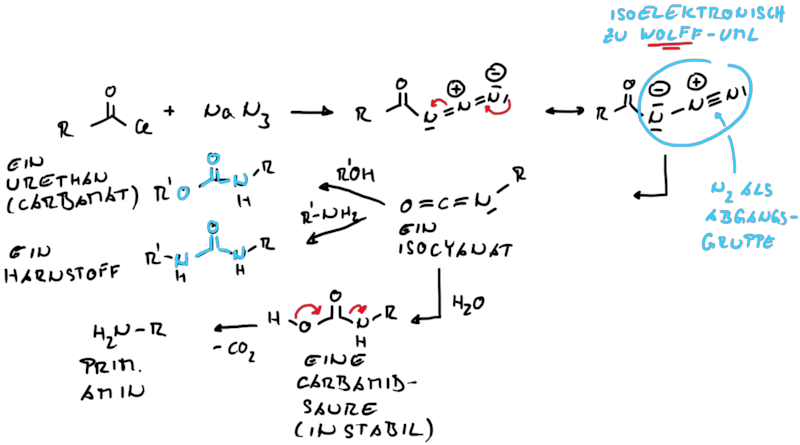
Die Curtius Umlagerung entspricht in Bezug auf Startmaterialien und Produkten, dass anstatt des Carbenkohlenstoffatoms ein Stickstoffatom zu finden ist. So kann ähnlich zur Wolff Umlagerung eine reaktive Vorstufe, hier das Acylazid, durch Umsetzung eines Carbosäurechlorids mit Natriumazid erhalten werden (Abb. 13.1).
Ähnlich zur Wolff Umlagerung wird ein Heterocumulen (hier ein Isocycanat) gebildet (►Frage: Wie lautet die Stoffklasse des Heterocumulens bei der Wolf Umlagerung?). Auch das Isocyanat geht bereitwillig Reaktionen mit Nucleophilen wie Alkoholen oder Aminen ein.
Auch für diese Nitren-Umlagerung wurden Varianten zu dessen Erzeugung entwickelt:
► Lossen, Schmidt und Hofmann Umlagerung
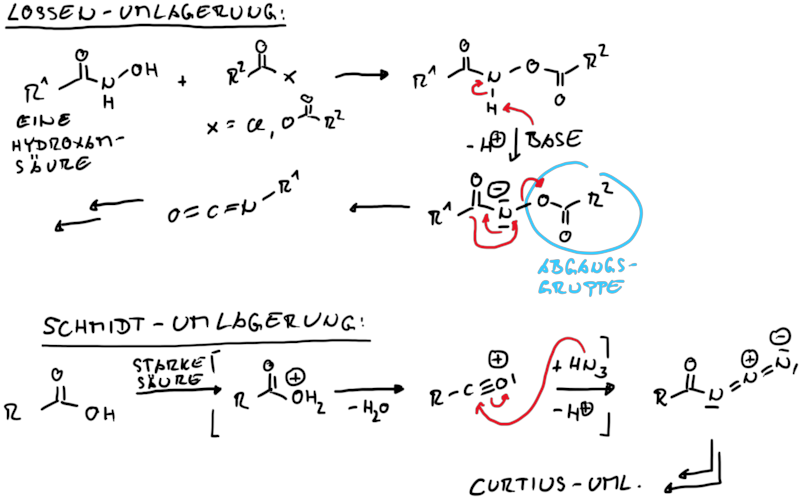
Ähnlich zu den Carben-Umlagerungen ist die Erzeugung der reaktiven Stufe unterschiedlich, jedoch die Folgereaktion der Nitren-Umlagerung der Curtius Umlagerung gleich (Abb. 13.2).
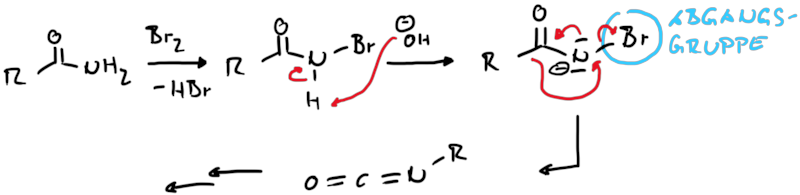
Isocycanate lassen sich auch direkt aus primären Carbonsäureamiden durch die Hofmann Umlagerung erzeugen. Dazu werden die Amide mit Brom in alkalischer Läsung umgesetzt. Dadurch wird wieder eine Abgangsgruppe an einer elektronenarmen Stickstoffkomponente erzeugt, was in situ wirder das Nitren für die Umlagerung bereitstellt (Abb. 13.3).
► Beckmann Umlagerung
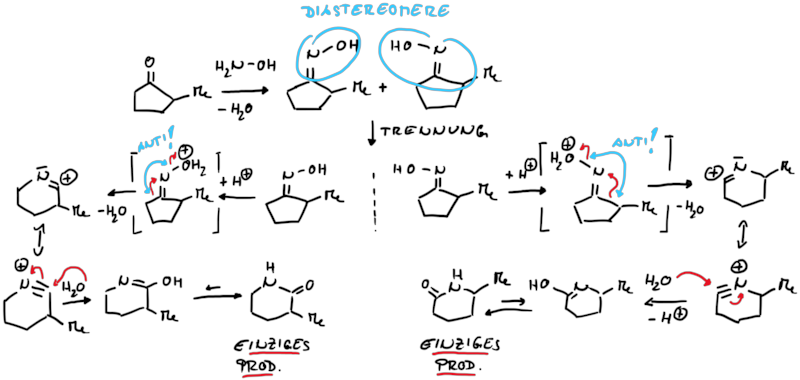
Die Nitren-Umlagerungen haben allerdings eine erweiterte Reaktivität, da entsprechende Oximderivate ebenfalls durch Bildung einer Elektronenmangelverbindung im Zuge einer konzertierten Umlagerung umlagern.
Speziell in diesem Fall ist, dass nur der anti-stehende Rest unabhängig seines Substitutionsgrades auf das elektronendefizitäre Stickstoffatom wandert (vgl. Abb. 13.4 und 13.5).
Bei der Beckmann Umlagerung spielt nicht die thermodynamische Stabilität des wandernden Restes oder die Stabilität des Produktes eine Rolle, sondern ausschliesslich die stereochemische Ausrichtung der Abgangsgruppe. Starmeterialien für die Beckmann Umlagerung werden leicht durch die Kondensation einer Carbonylverbindung (Keton oder Aldehyd) mit Hydroxylamin erhalten. Die Oxime können durch unterschiedliche Reagenzien (z. B. H2SO4, Ts-Cl, P2O5, H3PO4, Polyphosphorsäure, Dicyclohexylcarbodiimid) für die Umlagerung aktiviert werden (Abb. 13.5).
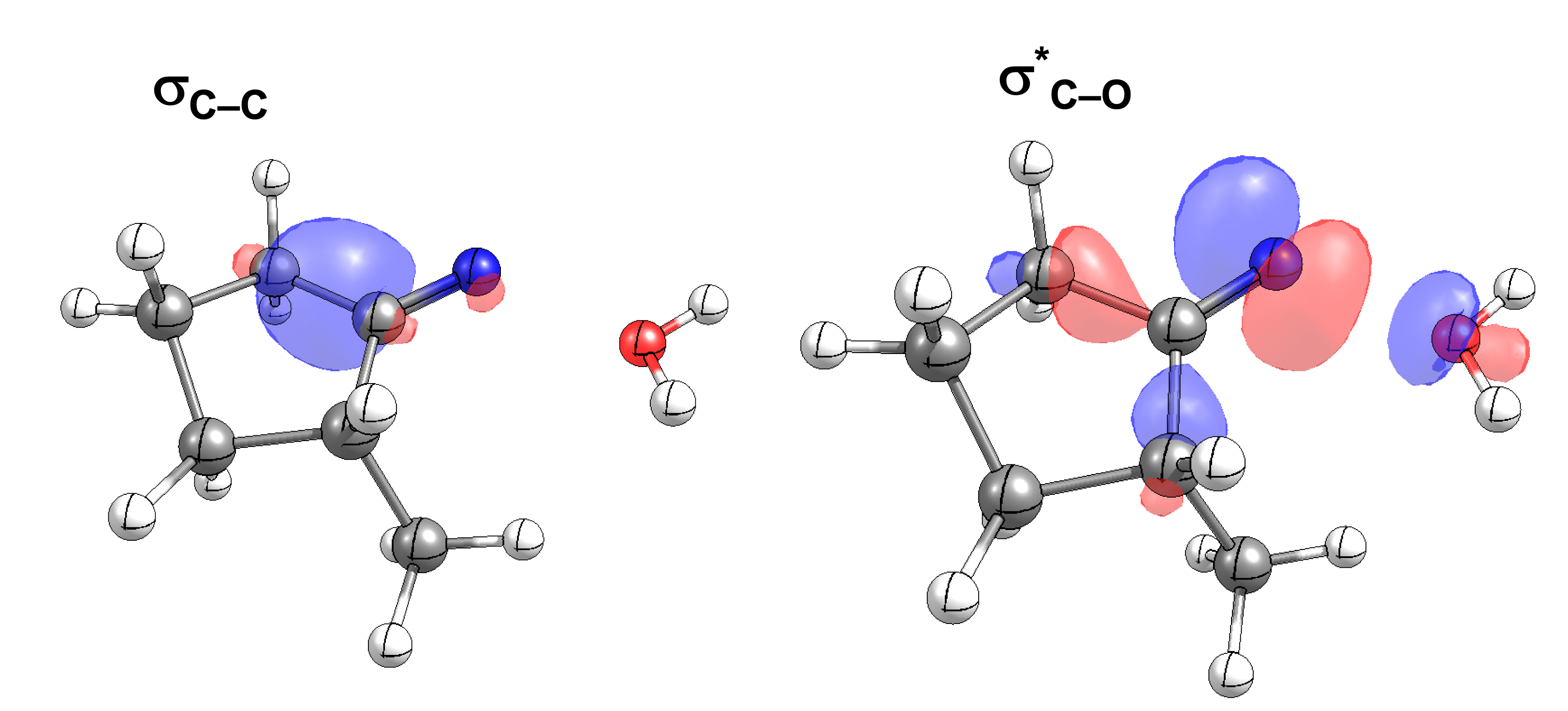
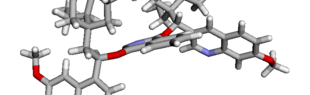
Das interaktive 3D-Modell (rechts, für Orbitale in neuem Fenster öffnen, Externer Link) zeigt die parallele Anordnung des σ-Orbitals der wandernden R-CH2-Gruppe (vgl. Z-Diastereomer, links Abb. 13.5) mit dem σ*-Orbital (antibindendes N-O Orbital) der N-O Bindung.
Diese Umlagerung gleich einem Rückseitenangriff an dem σ*-Orbital der N-O durch das σ-Orbital der C-C Bindung. Dadurch wird die Abgangsgruppe verdrängt und die neue C-N Bindung gebildet. Das gespannte Nitriliumion wird durch Nucleophile schnell abgefangen (Animation der Umlagerung). Durch die Notwendigkeit des Rückseitenangriffes wird die Stereoselektivität der Reaktion bestimmt.
► Neber Umlagerung
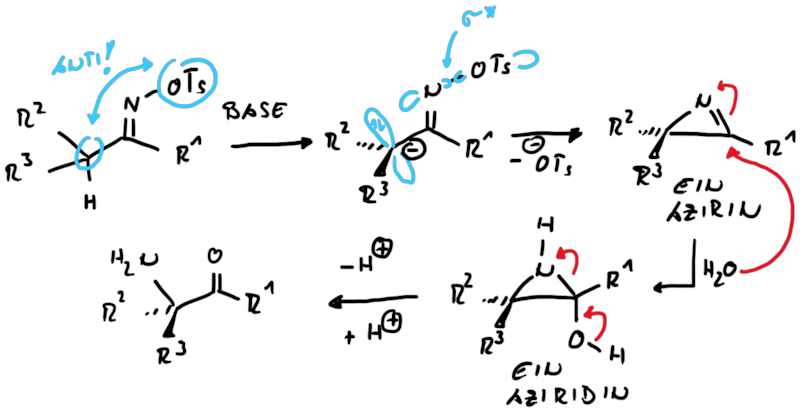
Die Neber Umlagerung geht auf die Grundlagen der Beckmann Umlagerung zurück, mit dem Unterschied, dass statt des σ-Orbitals ein besetztes p-Orbital für den Rückseitenangriff genutzt wird (Abb. 13.6).
Das in situ erzeugte Azirin wird schnell durch Nucleophile angegriffen, hier durch Wasser. Das Halbaminal ist instabil und das Aziridin-Intermediat öffnet zu synthetisch wertvollen α-Aminoketonen.